Oxidanter produceres generelt på en kontrolleret måde for at regulere væsentlige processer i den menneskelige krop, herunder celledeling, inflammation, immunfunktion, autofagi og stressrespons. Den ukontrollerede produktion af disse oxidanter kan dog bidrage til oxidativt stress, som kan påvirke cellulær funktion, hvilket fører til udvikling af toksicitet, kronisk sygdom
Indholdsfortegnelse
Abstrakt
Den transkriptionsfaktor NF-E2 p45-relaterede faktor 2 (Nrf2; gennavn NFE2L2) tillader tilpasning og overlevelse under stresstilstande ved at regulere genekspressionen af forskellige netværk af cytobeskyttende proteiner, herunder antioxidant-, anti-inflammatoriske og afgiftningsenzymer. som proteiner, der hjælper med reparation eller fjernelse af beskadigede makromolekyler. Nrf2 har en afgørende rolle i opretholdelsen af cellulær redox-homeostase ved at regulere biosyntesen, udnyttelsen og regenereringen af glutathion, thioredoxin og NADPH og ved at kontrollere produktionen af reaktive oxygenarter af mitokondrier og NADPH-oxidase. Under homøostatiske forhold påvirker Nrf2 mitokondriemembranpotentialet, fedtsyreoxidation, tilgængeligheden af substrater (NADH og FADH2/succinat) til respiration og ATP-syntese. Under betingelser med stress eller vækstfaktorstimulering modvirker aktivering af Nrf2 den øgede produktion af reaktive oxygenarter i mitokondrier via transkriptionel opregulering af afkoblingsprotein 3 og påvirker mitokondriel biogenese ved at opretholde niveauerne af nuklear respiratorisk faktor 1 og peroxisomproliferator-aktiveret receptor ? coactivator 1?, såvel som ved at fremme purin-nukleotidbiosyntese. Farmakologiske Nrf2-aktivatorer, såsom det naturligt forekommende isothiocyanat sulforaphane, hæmmer oxidant-medieret åbning af mitokondrielle permeabilitetsovergangsporer og mitokondriel hævelse. Mærkeligt nok er en syntetisk 1,4-diphenyl-1,2,3-triazolforbindelse, oprindeligt designet som
nøgleord: Bioenergetik, Cytobeskyttelse, Keap1, Mitokondrier, Nrf2, Frie radikaler
Highlights
- Nrf2 har en afgørende rolle i at opretholde cellulær redox-homeostase.
- Nrf2 påvirker mitokondrielle membranpotentiale og ATP-syntese.
- Nrf2 påvirker mitokondriel fedtsyreoxidation.
- Nrf2 understøtter mitokondriernes strukturelle og funktionelle integritet.
- Nrf2-aktivatorer har gavnlige virkninger, når mitokondriefunktionen er kompromitteret.
Introduktion
Transkriptionsfaktoren NF-E2 p45-relateret faktor 2 (Nrf2; gennavn NFE2L2) regulerer ekspressionen af netværk af gener, der koder for proteiner med forskellige cytobeskyttende aktiviteter. Nrf2 selv styres primært på niveauet af proteinstabilitet. Under basale forhold er Nrf2 et kortlivet protein, der udsættes for kontinuerlig ubiquitinering og proteasomal nedbrydning. Der er tre kendte ubiquitin-ligasesystemer, der bidrager til nedbrydningen af Nrf2. Historisk set var den første negative regulator af Nrf2, der blev opdaget, Kelch-lignende ECH-associeret protein 1 (Keap1) [1], et substratadapterprotein for Cullin 3 (Cul3)/Rbx1 ubiquitinligase [2], [3], [ 4]. Keap1 bruger en meget effektiv cyklisk mekanisme til at målrette Nrf2 til ubiquitinering og proteasomal nedbrydning, hvor Keap1 kontinuerligt regenereres, hvilket tillader cyklussen at fortsætte (fig. 1A) [5]. Nrf2 udsættes også for nedbrydning medieret af glykogensyntasekinase (GSK)3/a-TrCP-afhængig Cul1-baseret ubiquitinligase [6], [7]. Senest blev det rapporteret, at under tilstande med endoplasmatisk retikulumstress, bliver Nrf2 ubiquitineret og nedbrudt i en proces medieret af E3 ubiquitin-ligasen Hrd1 [8].
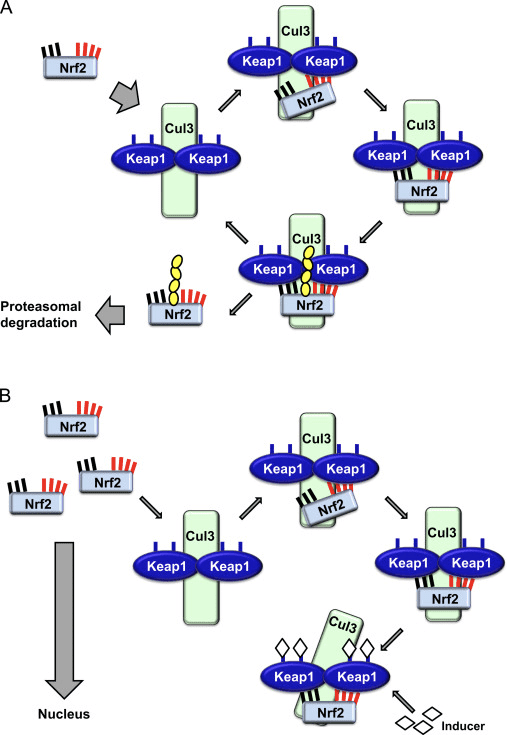
Ud over at fungere som et ubiquitin-ligase-substratadapterprotein er Keap1 også sensoren for en bred vifte af småmolekylære aktivatorer af Nrf2 (kaldet inducere) [9]. Inducere blokerer cyklussen af Keap1-medieret nedbrydning af Nrf2 ved kemisk at modificere specifikke cysteinrester i Keap1 [10], [11] eller ved direkte at forstyrre Keap1:Nrf2-bindingsgrænsefladen [12], [13]. Som følge heraf nedbrydes Nrf2 ikke, og transkriptionsfaktoren akkumuleres og translokeres til kernen (Fig. 1B), hvor den danner en heterodimer med et lille Maf-protein; binder til antioxidant-respons-elementer, de opstrøms regulatoriske områder af dets målgener; og initierer transkription [14], [15], [16]. Batteriet af Nrf2-mål omfatter proteiner med forskellige cytobeskyttende funktioner, herunder enzymer af xenobiotisk metabolisme, proteiner med antioxidant- og antiinflammatoriske funktioner og proteasomale underenheder, samt proteiner, der regulerer cellulær redox-homeostase og deltager i intermediær metabolisme.
Nrf2: en Master Regulator of Cellular Redox Homeostase
Funktionen af Nrf2 som en master regulator af cellulær redox homeostase er bredt anerkendt. Genekspressionen af både de katalytiske og de regulatoriske underenheder af β-
I betragtning af Nrf2's afgørende rolle som en masterregulator af cellulær redoxhomeostase er det ikke overraskende, at sammenlignet med WT-celler er niveauerne af reaktive oxygenarter (ROS) højere i celler, hvor Nrf2 er blevet forstyrret (Nrf2-KO) [35]. Denne forskel er især slående ved udfordring med midler, der forårsager oxidativ stress. Desuden er celler, der mangler Nrf2, meget mere følsomme over for toksiciteten af oxidanter af forskellige typer og kan ikke beskyttes af Nrf2-inducere, som under de samme betingelser giver effektiv og langvarig beskyttelse til WT-celler [29], [36] , [37]. Ud over den overordnede cellulære redox-homeostase er Nrf2 også kritisk for opretholdelsen af mitokondriel redox-homeostase. Sammenlignet med WT er den samlede mitokondrielle NADH-pulje signifikant øget i Keap1-KO og dramatisk reduceret i Nrf2-KO-celler [35].
Ved hjælp af levende cellebilleddannelse overvågede vi for nylig hastighederne for ROS-produktion i primære glioneuronale cokulturer og hjernevævsskiver isoleret fra WT, Nrf2-KO eller Keap1-knockdown (Keap1-KD) mus [38]. Som forventet var hastigheden af ROS-produktion hurtigere i Nrf2-KO-celler og væv sammenlignet med deres WT-modstykker. Vi gjorde dog den uventede observation, at sammenlignet med WT har Keap1-KD-celler også højere ROS-produktion, selvom størrelsen af forskellen mellem WT- og Keap1-KD-genotyperne var mindre end den mellem WT og Nrf2-KO . Vi analyserede derefter mRNA-niveauerne af NOX2 og NOX4, de katalytiske underenheder af de to NADPH-oxidase (NOX) isoformer, der er blevet impliceret i hjernepatologi, og fandt ud af, at NOX2 er dramatisk øget under forhold med Nrf2-mangel, hvorimod NOX4 opreguleres, når Nrf2 er konstitutivt aktiveret, dog i mindre omfang. Kvantitativt svarer størrelsen af opregulering i celler og væv fra mutantmusene til de tilsvarende stigninger i ROS-produktion [38]. Interessant nok regulerer Nrf2 ikke kun NADPH-oxidase, men ROS produceret af NADPH-oxidase kan aktivere Nrf2, som vist i lungeepitelceller og kardiomyocytter [39], [40]. Ydermere har en meget nylig undersøgelse vist, at den NADPH-oxidaseafhængige aktivering af Nrf2 udgør en vigtig endogen mekanisme til beskyttelse mod mitokondriel skade og celledød i hjertet under kronisk trykoverbelastning [41].
Ud over den katalytiske aktivitet af NADPH-oxidase er mitokondriel respiration en anden vigtig intracellulær kilde til ROS. Ved brug af den mitokondriespecifikke probe MitoSOX har vi undersøgt bidraget af ROS af mitokondriel oprindelse til den samlede ROS-produktion i primære glioneuronale cokulturer isoleret fra WT, Nrf2-KO eller Keap1-KD mus [38]. Som forventet havde Nrf2-KO-celler højere hastigheder af mitokondriel ROS-produktion end WT. I overensstemmelse med resultaterne for den samlede ROS-produktion var hastighederne for mitokondriel ROS-produktion i Keap1-KD også højere sammenlignet med WT-celler. Det er vigtigt, at blokering af kompleks I med rotenon forårsagede en dramatisk stigning i mitokondriel ROS-produktion i både WT- og Keap1-KD-celler, men havde ingen effekt i Nrf2-KO-celler. I modsætning til den forventede stigning i mitokondriel ROS-produktion i WT-celler efter tilsætning af pyruvat (for at øge tilgængeligheden af NADH, øge mitokondriel membranpotentiale og normalisere respiration), faldt produktionen af ROS i Nrf2-KO-celler. Tilsammen tyder disse resultater stærkt på, at i fravær af Nrf2: (i) aktiviteten af kompleks I er svækket, (ii) den forringede aktivitet af kompleks I skyldes begrænsning af substrater, og (iii) den svækkede aktivitet af kompleks I er en af hovedårsagerne til den øgede mitokondrielle ROS-produktion, muligvis på grund af omvendt elektronstrøm fra kompleks II.
Nrf2 påvirker mitokondriel membranpotentiale og respiration
Det mitokondrielle membranpotentiale (??m) er en universel indikator for mitokondriel sundhed og cellens metaboliske tilstand. I en sund celle opretholdes ??m af den mitokondrielle respiratoriske kæde. Interessant nok har en stabil isotopmærkning med aminosyrer i kulturbaseret proteomisk undersøgelse i den østrogenreceptor-negative ikke-tumorogene humane brystepitel MCF10A-cellelinje vist, at den mitokondrielle elektrontransportkæde-komponent NDUFA4 opreguleres af farmakologisk aktivering (af sulforaphane,) hvorimod genetisk opregulering af Nrf2 (ved Keap2 knockdown) fører til nedregulering af cytochrom c oxidase underenhederne COX1 og COX2I4 [1]. En undersøgelse af leverproteomet ved hjælp af todimensionel gelelektroforese og matrix-assisteret laserdesorptions-/ioniseringsmassespektrometri har fundet ud af, at Nrf42 regulerer ekspressionen af ATP-syntase-underenhed ? [2]. Derudover er mitokondrieproteinet DJ-43, som spiller en rolle i opretholdelsen af aktiviteten af kompleks I [1], blevet rapporteret at stabilisere Nrf44 [2], [45], selvom de neurobeskyttende virkninger af farmakologisk eller genetisk aktivering af Nrf46 er uafhængige af DJ-2 [1]. Konsekvenserne af disse observationer for mitokondriel funktion er dog ikke blevet undersøgt.
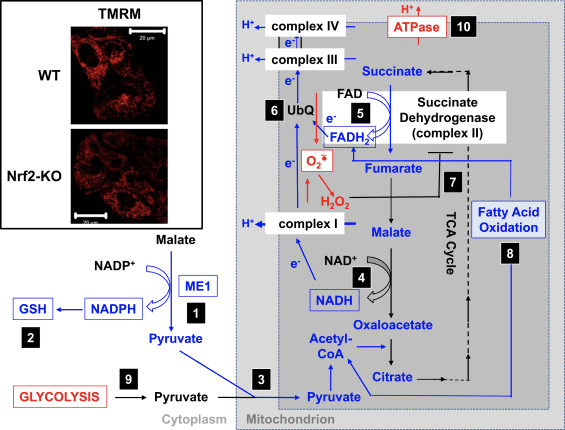
I overensstemmelse med den svækkede aktivitet af kompleks I under betingelser med Nrf2-mangel er den basale ??m lavere i Nrf2-KO museembryonale fibroblaster (MEF'er) og dyrkede primære glioneuronale celler sammenlignet med deres WT-modstykker (fig. 3, indsat) [35]. I modsætning hertil er den basale ??m højere, når Nrf2 er genetisk konstitutivt opreguleret (ved knockdown eller knockout af Keap1). Disse forskelle i ??m blandt genotyperne indikerer, at respirationen påvirkes af aktiviteten af Nrf2. Faktisk har evaluering af iltforbruget i den basale tilstand afsløret, at sammenlignet med WT er iltforbruget lavere i Nrf2-KO og Keap1-KO MEF'er med henholdsvis ~50 og ~35%.
Disse forskelle i µm og respiration blandt genotyperne afspejles af hastigheden for udnyttelse af substrater til mitokondriel respiration. Anvendelse af substrater til tricarboxylsyre (TCA) cyklussen (malat/pyruvat, som igen øger produktionen af kompleks I-substratet NADH) eller methylsuccinat, et substrat for kompleks II, forårsager en trinvis stigning i ??m i både WT og Keap1-KD-neuroner, men stigningshastigheden er højere i Keap1-KD-celler. Endnu vigtigere er, at formerne af responsen på disse TCA-cyklussubstrater er forskellige mellem de to genotyper, hvorved den hurtige stigning i μm i Keap1-KD-celler efter substrattilsætning efterfølges af et hurtigt fald snarere end et plateau, hvilket tyder på et usædvanligt hurtigt forbrug af underlag. Disse resultater er i tæt overensstemmelse med de meget lavere (med 50-70%) niveauer af malat, pyruvat og succinat, der er blevet observeret efter en 1-times puls af [U-13C6]glukose i Keap1-KO sammenlignet med WT MEF celler [24]. I Nrf2-KO neuroner er kun pyruvat i stand til at øge ??m, hvorimod malat og methylsuccinat forårsager mild depolarisering. Virkningen af Nrf2 på mitokondriel substratproduktion synes at være den vigtigste mekanisme, hvorved Nrf2 påvirker mitokondriel funktion. Det mitokondrielle NADH-redoxindeks (balancen mellem forbrug af NADH ved kompleks I og produktion af NADPH i TCA-cyklussen) er signifikant lavere i Nrf2-KO-celler sammenlignet med deres WT-modstykker, og desuden er hastighederne for regenerering af puljerne af NADH og FADH2 efter inhibering af kompleks IV (ved brug af NaCN) er langsommere i mutantcellerne.
I mitokondrier isoleret fra murin hjerne og lever øger tilskud af substrater for kompleks I eller for kompleks II iltforbruget kraftigere, når Nrf2 aktiveres og mindre effektivt, når Nrf2 er forstyrret [35]. Således inducerer malat et højere iltforbrug i Keap1-KD sammenlignet med WT, men dets virkning er svagere i Nrf2-KO mitokondrier. Tilsvarende aktiverer succinat i nærvær af rotenon (når kompleks I hæmmes) iltforbruget i højere grad i Keap1-KD sammenlignet med WT, hvorimod responsen i Nrf2-KO mitokondrier er formindsket. Derudover er Nrf2-KO primære neuronale kulturer og mus mere følsomme over for toksiciteten af de komplekse II-hæmmere 3-nitropropionsyre og malonat, hvorimod intrastriatal transplantation af Nrf2-overudtrykkende astrocytter er beskyttende [48], [49]. Tilsvarende er Nrf2-KO-mus mere følsomme over for, hvorimod genetisk eller farmakologisk aktivering af Nrf2 har beskyttende virkninger mod neurotoksicitet forårsaget af kompleks I-hæmmeren 1-methyl-4-phenylpyridinium-ion i 1-methyl-4-phenyl-1,2,3,6, 49-tetrahydropyridin dyremodel af Parkinsons sygdom [50], [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [XNUMX].
Respirationskontrolforholdet (RCR), forholdet mellem tilstand 3 (ADP-stimuleret) og tilstand 4 respiration (ingen ADP til stede), er nedsat i fravær af Nrf2, men RCR er ens mellem Keap1-KD og WT mitokondrier [35 ]. Da RCR er en indikation af graden af kobling af mitokondriel respiratorisk kædeaktivitet til oxidativ fosforylering, indikerer dette fund, at den højere respirationshastighed i Keap1-KD mitokondrier ikke skyldes afkobling af oxidativ fosforylering. Det tyder endvidere på, at oxidativ phosphorylering er mere effektiv, når Nrf2 er aktiveret. Den højere respirationshastighed i Keap1-KD mitokondrier er i overensstemmelse med de højere niveauer af mitokondriel ROS-produktion [38], da højere respirationshastigheder kan føre til øget elektronlækage. Men under forhold med oxidativ stress modvirkes den øgede ROS-produktion af den Nrf2-afhængige transkriptionelle opregulering af afkoblingsprotein 3 (UCP3), som øger protonkonduktansen af den mitokondrielle indre membran og som følge heraf nedsætter produktionen af superoxid [62]. For ganske nylig blev det vist, at lipidperoxidationsproduktet 4-hydroxy-2-nonenal medierer den Nrf2-afhængige opregulering af UCP3 i kardiomyocytter; dette kan være særligt vigtigt for beskyttelse under forhold med oxidativ stress, såsom dem under iskæmi-reperfusion [63].
Nrf2 påvirker effektiviteten af oxidativ phosphorylering og Syntese af ATP
I overensstemmelse med virkningen af Nrf2 på respiration, i hjerne- og levermitokondrier, resulterer Nrf2-mangel i en nedsat effektivitet af oxidativ fosforylering (som estimeret ved forholdet mellem ADP og oxygen, som forbruges til ATP-syntese), hvorimod Nrf2-aktivering (Keap1) -KD) har den modsatte effekt [35]. Sammenlignet med WT er ATP-niveauerne signifikant højere i celler med konstitutiv opregulering af Nrf2 og lavere, når Nrf2 er slået ned [64] eller forstyrret [35]. Desuden har brugen af inhibitorer af oxidativ phosphorylering (oligomycin) eller glykolyse (iodoeddikesyre) afsløret, at Nrf2 ændrer måden, hvorpå celler producerer ATP. I WT-neuroner forårsager oligomycin således et fuldstændigt fald i ATP, og iodeddikesyre har ingen yderligere effekt. Bemærkelsesværdigt, i Nrf2-KO-celler øger oligomycin ATP-niveauerne, som derefter langsomt, men fuldstændigt, udtømmes af iodeddikesyre, hvilket indikerer, at i fravær af Nrf2 er glykolyse og ikke oxidativ phosphorylering hovedkilden til ATP-produktion. Interessant nok, på trods af den øgede effektivitet af oxidativ phosphorylering i Keap1-KD-celler, resulterer tilføjelse af oligomycin i et ~80% fald i ATP-niveauer, og iodeddikesyre forårsager et yderligere ~20% fald. Således reducerer enten Nrf2-mangel eller dens konstitutive aktivering bidraget fra oxidativ phosphorylering og øger bidraget af glykolyse til syntesen af ATP. Denne effekt er især udtalt, når Nrf2 er fraværende og er i overensstemmelse med ??m'ens afhængighed af tilstedeværelsen af glukose i mediet [35] og de øgede niveauer af glykolytiske mellemprodukter (G-6-P, F-6-P , dihydroxyacetonephosphat, pyruvat og laktat) efter knockdown af Nrf2 [24].
Stigningen i ATP-niveauer efter inhibering af F1F0-ATPasen med oligomycin indikerer, at i fravær af Nrf2 fungerer F1F0-ATPasen som en ATPase og ikke en ATP-syntase, dvs. den fungerer omvendt. En sådan vending i aktivitet afspejler højst sandsynligt behovet for at pumpe protoner hen over den indre mitokondriemembran i et forsøg på at opretholde ??m, hvilket er afgørende for den funktionelle integritet af denne organel. Reverseringen af funktionen af F1F0-ATPase er også bevist af den observerede mitokondrielle depolarisering ved oligomycinadministration til Nrf2-KO-celler, hvilket er i skarp kontrast til den hyperpolarisering, der forekommer i deres WT- eller Keap1-deficiente modstykker [35]. Samlet set ser det ud til, at under forhold med Nrf2-mangel produceres ATP primært i glykolyse, og denne ATP bruges derefter delvist af F1F0-ATPasen til at opretholde ??m.
Nrf2 forbedrer mitokondriel fedtsyre Ooxidation
Virkningen af Nrf2-mangel på ??m er især udtalt, når celler inkuberes i medium uden glucose, og ??m er ~50% lavere i Nrf2-KO sammenlignet med WT-celler [35]. Under forhold med glukosemangel er mitokondriel fedtsyreoxidation (FAO) en vigtig leverandør af substrater til respiration og oxidativ fosforylering, hvilket tyder på, at Nrf2 kan påvirke FAO. Faktisk er effektiviteten af FAO for både den langkædede (C16:0) mættede fedtsyre palmitinsyre og den kortkædede (C6:0) hexansyre højere i Keap1-KO MEF'er og isolerede hjerte- og levermitokondrier end i deres WT-modstykker, hvorimod det er lavere i Nrf2-KO-celler og mitokondrier [65]. Disse virkninger er også yderst relevante for mennesker: faktisk er metaboliske ændringer, der indikerer bedre integration af FAO med aktiviteten af TCA-cyklussen, blevet rapporteret at forekomme i humane interventionsstudier med diæter rig på glucoraphanin, forløberen for den klassiske Nrf2-aktivator sulforaphane [ 66].
Under det første trin af mitokondriel FAO forlader pro-R-brinten af β-carbonet som et hydrid, der reducerer FAD-cofaktoren til FADH2, som igen overfører elektroner til ubiquinon (UbQ) i respirationskæden, hvilket i sidste ende bidrager til ATP-produktion . Mens stimulering af FAO med palmitoylcarnitin i fravær af glucose forårsager den forventede stigning i ATP-niveauerne i WT- og Keap1-KO-celler, hvor ATP-stigningen er hurtigere i Keap1-KO-celler, producerer den identiske behandling ingen ATP-ændringer i Nrf2-KO MEF'er [65]. Dette eksperiment viser, at i fravær af Nrf2 undertrykkes FAO, og desuden implicerer det undertrykkelse af FAO som en af årsagerne til de lavere ATP-niveauer under betingelser med Nrf2-mangel [35], [64].
Navnlig har humane 293 T-celler, hvor Nrf2 er blevet dæmpet, en lavere ekspression af CPT1 og CPT2[67], to isoformer af carnitin palmitoyltransferase (CPT), det hastighedsbegrænsende enzym i mitokondriel FAO. I overensstemmelse hermed er mRNA-niveauerne af Cpt1 lavere i leveren af Nrf2-KO sammenlignet med WT-mus [68]. CPT katalyserer overførslen af acylgruppen i en langkædet fedtsyreacyl-CoA fra coenzym A til l-carnitin og tillader således import af acylcarnitin fra cytoplasmaet ind i mitokondrierne. Selvom dette ikke er blevet undersøgt til dato, er det muligt, at ud over de transkriptionelle virkninger på CPT1-ekspression, kan Nrf2 også påvirke funktionen af dette enzym ved at kontrollere niveauerne af dets vigtigste allosteriske inhibitor, malonyl-CoA. Dette skyldes, at Nrf2 ved en mekanisme, der i øjeblikket er uklar, negativt regulerer ekspressionen af stearoyl CoA desaturase (SCD) [69] og citratlyase (CL) [69], [70]. Mærkeligt nok fører knockout eller inhibering af SCD til øget phosphorylering og aktivering af AMP-aktiveret proteinkinase (AMPK) [71], [72], [73], og det kan spekuleres i, at i fravær af Nrf2, SCD-niveauerne vil øge, til gengæld sænke AMPK-aktiviteten. Dette kan yderligere forstærkes af de reducerede proteinniveauer af AMPK, der er blevet observeret i leveren af Nrf2-KO-mus [68], et fund, der er i tæt overensstemmelse med de øgede AMPK-niveauer, som er blevet rapporteret i leveren af Keap1-KD mus [74]. En konsekvens af den nedsatte AMPK-aktivitet er lindring af dens hæmmende phosphorylering (ved Ser79) af acetyl-CoA-carboxylase (ACC) [75], som kunne opreguleres yderligere transkriptionelt i fravær af Nrf2, fordi den nedreguleres af Nrf2-aktivering [70] ]. Den høje ACC-aktivitet i kombination med den opregulerede CL-ekspression, der vil øge produktionen af acetyl-CoA, substratet for ACC, kan i sidste ende øge niveauerne af ACC-produktet, malonyl-CoA. De høje niveauer af malonyl-CoA vil hæmme CPT og derved mindske transporten af fedtsyrer ind i mitokondrierne. Endelig regulerer Nrf2 positivt ekspressionen af CD36 [76], en translokase, der importerer fedtsyrer over plasma og mitokondriemembraner. Således er en mekanisme, hvorved Nrf2 kan påvirke effektiviteten af mitokondriel FAO, ved at regulere importen af langkædede fedtsyrer til mitokondrierne.
Ud over direkte transkriptionel regulering kan Nrf2 også ændre effektiviteten af mitokondriel FAO ved dets virkninger på den cellulære redoxmetabolisme. Dette kan være særligt relevant, når Nrf2-aktivitet er lav eller fraværende, tilstande, der skifter den cellulære redoxstatus mod den oxiderede tilstand. Faktisk er flere FAO-enzymer blevet identificeret som følsomme over for redoxændringer. Et sådant enzym er meget langkædet acyl-CoA-dehydrogenase (VLCAD), som bidrager med mere end 80 % til palmitoyl-CoA-dehydrogeneringsaktiviteten i humant væv [77]. Interessant nok, Hurd et al. [78] har vist, at VLCAD indeholder cysteinrester, der signifikant ændrer deres redoxtilstand ved eksponering af isolerede rottehjertemitokondrier for H2O2. Derudover forbedrer S-nitrosylering af murint hepatisk VLCAD ved Cys238 den katalytiske effektivitet af enzymet [79], og det er sandsynligt, at oxidation af det samme cystein kan have den modsatte effekt, hvilket i sidste ende sænker effektiviteten af mitokondriel FAO. Det er derfor muligt, at selvom ekspressionsniveauerne af VLCAD ikke er signifikant forskellige i WT, Nrf2-KO eller Keap1-KO MEF'er [65], kan enzymaktiviteten af VLCAD være lavere i fravær af Nrf2 på grund af de højere niveauer af ROS.
Baseret på alle disse resultater kan det foreslås, at (fig. 3): i fravær af Nrf2 er NADPH-niveauerne lavere på grund af nedsat ekspression af ME1, IDH1, G6PD og PGD. Niveauerne af reduceret glutathion er også lavere på grund af nedsat ekspression af enzymer, der deltager i dets biosyntese og regenerering, og de lavere niveauer af NADPH, der er nødvendige for omdannelsen af den oxiderede til den reducerede form af glutathion. Den lave ekspression af ME1 vil mindske puljen af pyruvat, der kommer ind i mitokondrierne, hvor glykolyse bliver den vigtigste kilde til pyruvat. Genereringen af NADH er langsommere, hvilket fører til nedsat aktivitet af kompleks I og øget mitokondriel ROS-produktion. Reduktionen af FAD til FADH2 er også langsommere, i det mindste delvist på grund af mindre effektiv fedtsyreoxidation, hvilket kompromitterer elektronstrømmen fra FADH2 til UbQ og ind i kompleks III. Da UbQH2 er en aktivator af succinatdehydrogenase [80], kan nedsættelse af dets dannelse sænke enzymaktiviteten af succinatdehydrogenase. De øgede niveauer af superoxid og hydrogenperoxid kan hæmme kompleks II-aktivitet yderligere [81]. Den lavere effektivitet af fedtsyreoxidation bidrager til den reducerede substrattilgængelighed for mitokondriel respiration og ATP-produktion ved oxidativ fosforylering. Som en kompenserende mekanisme forstærkes glykolysen. ATP-syntase fungerer omvendt som en ATPase i et forsøg på at opretholde ??m.
Nrf2 og Mitochondrial Biogenese
Det er blevet rapporteret, at sammenlignet med WT har leveren af Nrf2-KO mus et lavere mitokondrieindhold (som bestemt af forholdet mellem mitokondrie og nukleært DNA); dette reduceres yderligere med en 24-timers faste i både WT- og Nrf2-KO-mus; i modsætning hertil, selvom det ikke er forskelligt fra WT under normale fodringsforhold, påvirkes mitokondrieindholdet i mus med høj Nrf2-aktivitet ikke af faste [82]. Interessant nok fremmer tilskud med Nrf2-aktivatoren (R)-a-liponsyre [83], [84], [85] mitokondriel biogenese i 3T3-L1-adipocytter [86]. To klasser af nukleare transkriptionelle regulatorer spiller kritiske roller i mitokondriel biogenese. Den første klasse er transkriptionsfaktorer, såsom nukleære respiratoriske faktorer11 og 2, som styrer ekspressionen af gener, der koder for underenheder af de fem respiratoriske komplekser, mitokondrielle translationskomponenter og hæmbiosyntetiske enzymer, der er lokaliseret til mitokondriematrixen [88]. Piantadosi et al. [89] har vist, at den Nrf2-afhængige transkriptionelle opregulering af nuklear respiratorisk faktor 1 fremmer mitokondriel biogenese og beskytter mod cytotoksiciteten af det kardiotoksiske antracyklin kemoterapeutiske middel doxorubicin. I modsætning hertil har Zhang et al. [82] har rapporteret, at genetisk aktivering af Nrf2 ikke påvirker den basale mRNA-ekspression af nuklear respiratorisk faktor 1 i den murine lever.
Den anden klasse af nukleare transkriptionelle regulatorer med kritiske funktioner i mitokondriel biogenese er transkriptionelle coaktivatorer, såsom peroxisomproliferator-aktiveret receptor ? coaktivatorer (PGC)1? og 1?, som interagerer med transkriptionsfaktorer, det basale transkriptionelle og RNA-splejsningsmaskineri og histonmodificerende enzymer [88], [90], [91]. Ekspressionen af PGC1-familien af coaktivatorer er påvirket af adskillige miljøsignaler. Behandling af humane fibroblaster med Nrf2-aktivatoren sulforaphane forårsager en stigning i mitokondriel masse og induktion af PGC1? og PGC1? [92], selvom den potentielle afhængighed af Nrf2 ikke blev undersøgt i denne undersøgelse. Diabetiske mus, hvor Nrf2 enten aktiveres af Keap1-genets hypomorfiske knockdown (db/db:Keap1flox/?:Nrf2+/+) eller forstyrrede (db/db:Keap1flox/?:Nrf2?/?) har lavere lever-PGC1? ekspressionsniveauer end kontroldyr (db/db:Keap1flox/+:Nrf2+/+) [93]. Ingen forskelle i mRNA-niveauerne for PGC1? ses i leveren fra ikke-diabetiske mus, der er enten WT eller Nrf2-KO, hvorimod disse niveauer er lavere i Nrf2-overudtrykkende (Keap1-KD og leverspecifikke Keap1-KO) dyr [82]. Især øger en 24-timers faste niveauerne af PGC1? mRNA i leveren af mus af alle genotyper, men stigningen er signifikant større i leveren af Nrf2-KO sammenlignet med WT eller Nrf2-overudtrykkende mus. Sammenlignet med WT viser Nrf2-KO-mus, der oplever septisk infektion eller akut lungeskade på grund af infektion, svækket transkriptionel opregulering af nuklear respiratorisk faktor 1 og PGC1? [94], [95]. Sammen antyder disse observationer, at Nrf2's rolle i at opretholde niveauerne af både nuklear respiratorisk faktor 1 og PGC1? er kompleks og bliver mest fremtrædende under stresstilstande.
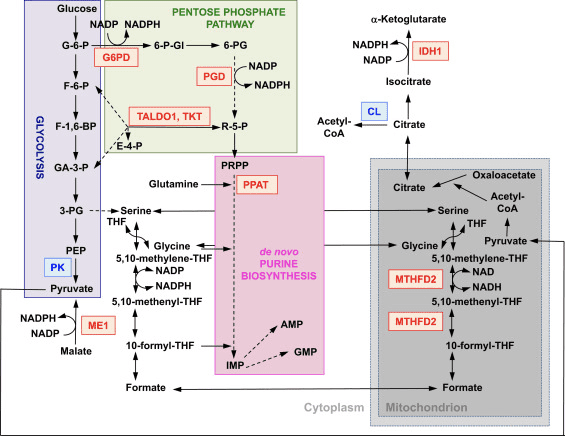
Ud over ekspression af gener, der koder for mitokondrielle proteiner, kræver mitokondriel biogenese syntese af nukleotider. Genetisk aktivering af Nrf2 øger purinbiosyntesen ved at opregulere pentosephosphatvejen og metabolismen af folat og glutamin, især i hurtigt prolifererende celler (fig. 2) [24]. Analyse af transkriptomet af mutant Drosophila, der mangler den mitokondrielle serin/threoninproteinkinase PTEN-induceret formodet kinase 1 (PINK1) har vist, at mitokondriel dysfunktion fører til transkriptionel opregulering af gener, der påvirker nukleotidmetabolismen [96], hvilket tyder på, at det forbedrede nukleotidbiosyntese-nukleotid repræsenterer en mekanisme til beskyttelse mod de neurotoksiske konsekvenser af PINK1-mangel. Nrf2 regulerer ekspressionen af phosphoribosyl pyrophosphat amidotransferase (PPAT), som katalyserer indgangen i den de novo purin nukleotid biosyntesevej, og mitokondriel methylentetrahydrofolat dehydrogenase 2 (MTHFD2) (fig. 2). Sidstnævnte er et bifunktionelt enzym med dehydrogenase- og cyclohydrolaseaktiviteter, der er afgørende for at tilvejebringe både glycin og formiat som kilder til en-carbon-enheder til purinbiosyntese i hurtigt voksende celler [97]. Det er derfor sandsynligt, at Nrf2-aktivering kan være beskyttende og kan vende mitokondriel dysfunktion i PINK1-mangel. Faktisk genopretter farmakologisk aktivering af Nrf2 af sulforaphane eller triterpenoidet RTA-408 µm og beskytter PINK1-mangelfulde celler mod dopamintoksicitet [98]. Selvom de underliggende mekanismer synes at være komplekse, tilsammen indikerer disse resultater, at Nrf2-aktivitet kan påvirke mitokondriel biogenese ved at påvirke ekspressionsniveauerne af kritiske transkriptionsfaktorer og coaktivatorer, såvel som ved at øge nukleotidbiosyntesen.
Nrf2 og Mitochondrial Integrity
Selvom direkte beviser ikke altid er tilgængelige, er der stærke indikationer på, at Nrf2 er vigtig for mitokondriel integritet, især under forhold med oxidativ stress. Mitokondrier isoleret fra hjernen og leveren hos rotter, der havde fået en enkelt dosis af Nrf2-aktivatoren sulforaphane, er modstandsdygtige over for åbning af mitokondriel permeabilitetsovergangspore (mPTP) forårsaget af oxidanten tert-butylhydroperoxid [99], [100]. mPTP, et kompleks, der gør det muligt for den mitokondriske indre membran at blive permeabel for molekyler med masser op til 1500 Da, blev for nylig identificeret til at være dannet fra dimerer af F0F1-ATP-syntasen [101]. Den sulforaphane-medierede resistens over for mPTP-åbning korrelerer med øget antioxidantforsvar, og niveauerne af mitokondriel GSH, glutathionperoxidase 1, æblesyreenzym 3 og thioredoxin 2 er alle opreguleret i mitokondrielle fraktioner isoleret fra sulforaphan-behandlede dyr [100].
Mitokondriel proteinskade og svækkelse af respiration forårsaget af det elektrofile lipidperoxidationsprodukt 4-hydroxy-2-nonenal svækkes i mitokondrier isoleret fra hjernebarken hos sulforaphane-behandlede mus [102]. I nyreepitelceller fra rotter og i nyrer er sulforaphan beskyttende mod cisplatin- og gentamicin-induceret toksicitet og tab af ??m[103], [104]. Beskyttelse mod et panel af oxidanter (superoxid, hydrogenperoxid, peroxynitrit) og elektrofiler (4-hydroxy-2-nonenal og acrolein) og en stigning i mitokondrielle antioxidantforsvar er også blevet observeret ved behandling af glatte muskelceller fra rotteaorta med sulforaphane [105 ]. I en model af kontrast-induceret akut nyreskade, blev iskæmisk prækonditionering af lemmer for nylig vist at have beskyttende virkninger, herunder hæmning af åbningen af mPTP og mitokondriel hævelse, ved aktivering af Nrf2 som følge af hæmningen af GSK3? [106].
Mitofagi, den proces, hvorved dysfunktionelle mitokondrier selektivt opsluges af autophagosomer og leveres til lysosomer for at blive nedbrudt og genanvendt af cellen, er afgørende for mitokondriel homeostase [107], [108]. Mens der ikke er etableret en årsagssammenhæng mellem Nrf2 og mitofagi, er der bevis for, at transkriptionsfaktoren kan være vigtig i mitokondriel kvalitetskontrol ved at spille en rolle i mitofagi. Dette kan være særligt fremtrædende under forhold med oxidativ stress. I en model af sepsis er stigningerne i niveauerne af autophagosommarkøren MAP1 let kæde 3-II (LC3-II) og cargoproteinet p62 24 timer efter infektion således undertrykt i Nrf2-KO sammenlignet med WT-mus [109] . En lille molekyle inducer af mitofagi (kaldet p62-medieret mitophagy inducer, PMI) blev for nylig opdaget; denne 1,4-diphenyl-1,2,3-triazolforbindelse blev oprindeligt designet som en Nrf2-aktivator, der forstyrrer interaktionen af transkriptionsfaktoren med Keap1 [110]. I lighed med celler, hvor Nrf2 er genetisk opreguleret (Keap1-KD eller Keap1-KO), har celler udsat for PMI højere hvilende ??m. Det er vigtigt, at stigningen i mitokondriel LC3-lokalisering, der observeres efter PMI-behandling af WT-celler, ikke forekommer i Nrf2-KO-celler, hvilket tyder på involvering af Nrf2.
Sidst har ultrastrukturel analyse af leversektioner afsløret tilstedeværelsen af hævede mitokondrier med reduceret crista og forstyrrede membraner i hepatocytter af Nrf2-KO, men ikke WT, mus, der var blevet fodret med en kost med højt fedtindhold i 24 uger; især viser disse lever tydelige tegn på oxidativt stress og inflammation [68]. Det kan konkluderes, at Nrf2 har en afgørende rolle i at opretholde mitokondriel integritet under forhold med oxidativt og inflammatorisk stress.
Sulforaphane og dens virkninger på kræft, dødelighed, aldring, hjerne og adfærd, hjertesygdomme og mere
Isothiocyanater er nogle af de vigtigste planteforbindelser, du kan få i din kost. Heri
Nøglesektioner:
- 00: 01: 14 - Kræft og dødelighed
- 00: 19: 04 - Aging
- 00: 26: 30 - Hjerne og adfærd
- 00: 38: 06 - Final recap
- 00: 40: 27 - Dosis
Fuld tidslinje:
- 00: 00: 34 - Introduktion af sulforaphane, et vigtigt fokus i videoen.
- 00: 01: 14 - Cruciferous vegetabilsk forbrug og reduktion af allårsag dødelighed.
- 00: 02: 12 - Prostatacancerrisiko.
- 00: 02: 23 - Kræftrisiko.
- 00: 02: 34 - Lungekræft i rygere risiko.
- 00: 02: 48 - Brystkræftrisiko.
- 00: 03: 13 - Hypotetisk: Hvad hvis du allerede har kræft? (Interventionel)
- 00:03:35 – Plausibel mekanismekørsel
kræften og dødelighedsassociative data. - 00: 04: 38 - Sulforaphane og kræft.
- 00:05:32 – Dyrebevis viser
stærk effekt af broccolispireekstrakt på blæretumorudvikling hos rotter. - 00: 06: 06 - Virkning af direkte tilsætning af sulforaphan hos patienter med prostatacancer.
- 00: 07: 09 - Bioakkumulering af isothiocyanatmetabolitter i egentligt brystvæv.
- 00: 08: 32 - Inhibering af brystcancerstamceller.
- 00: 08: 53 - Historie lektion: brassicas blev etableret som at have sundhedsegenskaber selv i det gamle Rom.
- 00: 09: 16 - Sulforaphans evne til at øge kræftfremkaldende udskillelse (benzen, acrolein).
- 00: 09: 51 - NRF2 som en genetisk switch via antioxidant responselementer.
- 00: 10: 10 - Hvordan NRF2 aktivering øger kræftfremkaldende udskillelse via glutathion-S-konjugater.
- 00: 10: 34 - Spiraler øger glutathion-S-transferase og reducerer DNA-beskadigelse.
- 00: 11: 20 - Broccoli-spire drikker øger benzenudskillelsen med 61%.
- 00: 13: 31 - Broccoli spirehomogenat øger antioxidant enzymer i den øvre luftvej.
- 00: 15: 45 - Cruciferous vegetabilsk forbrug og dødelighed i hjertesygdomme.
- 00: 16: 55 - Broccoli spire pulver forbedrer blodlipider og overordnet hjertesygdomsrisiko hos type 2 diabetikere.
- 00:19:04 – Begyndelsen af
aldring sektion. - 00:19:21 – Sulforaphan-beriget diæt forbedrer
levetid af biller fra 15 til 30% (under visse forhold). - 00: 20: 34 - Betydningen af lav inflammation for lang levetid.
- 00: 22: 05 - Cruciferous grøntsager og broccoli spire pulver synes at reducere et bredt udvalg af inflammatoriske markører hos mennesker.
- 00: 23: 40 - Mid-video recap: kræft, aldrende sektioner
- 00: 24: 14 - Musestudier tyder på, at sulforaphan kan forbedre adaptiv immunfunktion i alderdommen.
- 00:25:18 – Sulforaphane forbedrede hårvæksten i en musemodel af skaldethed.
Billede ved 00: 26: 10. - 00: 26: 30 - Begyndelse af hjerne- og adfærdssektionen.
- 00: 27: 18 - Effekt af broccoli-spireekstrakt på autisme.
- 00: 27: 48 - Virkning af glucoraphanin på skizofreni.
- 00: 28: 17 - Start af depression diskussion (sandsynlig mekanisme og undersøgelser).
- 00:31:21 – Musestudie med 10 forskellige modeller af stress-induceret depression viser sulforaphane, der er lige så effektivt som fluoxetin (
Prozac ). - 00: 32: 00 - Undersøgelse viser direkte indtagelse af glucoraphanin hos mus er tilsvarende effektiv til forebyggelse af depression fra social nederlagsspændingsmodel.
- 00: 33: 01 - Begyndelsen af neurodegenerationsafsnittet.
- 00: 33: 30 - Sulforaphane og Alzheimers sygdom.
- 00: 33: 44 - Sulforaphane og Parkinsons sygdom.
- 00: 33: 51 - Sulforaphane og Hungtington's sygdom.
- 00: 34: 13 - Sulforaphane øger varmechokproteiner.
- 00: 34: 43 - Begyndelse af traumatisk hjerneskade.
- 00: 35: 01 - Sulforaphane injiceret umiddelbart efter, at TBI forbedrer hukommelsen (musestudie).
- 00: 35: 55 - Sulforaphane og neuronal plasticitet.
- 00:36:32 – Sulforaphane forbedrer læring i
model type II diabetes hos mus. - 00:37:19 – Sulforaphane og
Duchenne muskeldystrofi. - 00: 37: 44 - Myostatininhibering i muskel-satellitceller (in vitro).
- 00: 38: 06 - Late video recap: dødelighed og kræft, DNA-beskadigelse, oxidativ stress og betændelse, udslip af benzen, kardiovaskulær sygdom, type II diabetes, hjernens virkninger (depression, autisme, skizofreni, neurodegeneration), NRF2-pathway.
- 00: 40: 27 - Tanker om at finde ud af en dosis broccolispirer eller sulforaphane.
- 00: 41: 01 - Anecdoter på spiring hjemme.
- 00: 43: 14 - På tilberedningstemperaturer og sulforafanaktivitet.
- 00: 43: 45 - Gut-bakteriekonvertering af sulforaphan fra glucoraphanin.
- 00: 44: 24 - Tilskud fungerer bedre, når de kombineres med aktiv myrosinase fra grøntsager.
- 00: 44: 56 - Madlavningsteknikker og cruciferous grøntsager.
- 00: 46: 06 - Isothiocyanater som goitrogener.

Nrf2 er en transkriptionsfaktor, som spiller en vigtig rolle i den menneskelige krops cellulære antioxidantforsvar. Det antioxidant-responsive element, eller ARE, er en reguleringsmekanisme af gener. Mange forskningsundersøgelser har vist, at Nrf2, eller NF-E2-relateret faktor 2, regulerer en lang række ARE-drevne gener gennem flere typer celler. Nrf2 viste sig også at spille en væsentlig rolle i cellulær beskyttelse og anti-carcinogenicitet, hvilket viser, at Nrf2 kan være en effektiv behandling i behandlingen af neurodegenerative sygdomme og kræftformer, der menes at være forårsaget af oxidativt stress.
Dr. Alex Jimenez DC, CCST Insight
Afsluttende Remarks
Selvom mange spørgsmål stadig er åbne, indikerer det tilgængelige eksperimentelle bevis klart, at Nrf2 er en vigtig aktør i opretholdelsen af mitokondriel homeostase og strukturel integritet. Denne rolle bliver særligt kritisk under forhold med oxidativ, elektrofil og inflammatorisk stress, når evnen til at opregulere Nrf2-medierede cytobeskyttende responser påvirker cellens og organismens generelle sundhed og overlevelse. Rollen af Nrf2 i mitokondriel funktion repræsenterer et andet lag af de brede cytobeskyttende mekanismer orkestreret af denne transkriptionsfaktor. Da mange menneskelige patologiske tilstande har oxidativt stress, inflammation og mitokondriel dysfunktion som væsentlige komponenter i deres patogenese, lover farmakologisk aktivering af Nrf2 et løfte om sygdomsforebyggelse og behandling. Omfattende forståelse af de præcise mekanismer, hvorved Nrf2 påvirker mitokondriel funktion, er afgørende for rationelt design af fremtidige kliniske forsøg og kan tilbyde nye biomarkører til overvågning af terapeutisk effekt.
Tak
Sciencedirect.com/science/article/pii/S0891584915002129
Formålet med artiklen ovenfor var at diskutere samt demonstrere den nye rolle af Nrf2 i mitokondriel funktion. Nrf2, eller nuklear faktor erythroid 2-relateret faktor, er en ny regulator af cellulær resistens over for oxidanter, som kan bidrage til oxidativt stress, som påvirker cellulær funktion og fører til udvikling af toksicitet, kronisk sygdom og endda kræft. Mens produktionen af oxidanter i den menneskelige krop kan tjene forskellige formål, herunder celledeling, inflammation, immunfunktion, autofagi og stressrespons, er det vigtigt at kontrollere deres overproduktion for at forhindre sundhedsproblemer. Omfanget af vores information er begrænset til kiropraktik og rygsøjlesundhedsproblemer. For at diskutere emnet, er du velkommen til at spørge Dr. Jimenez eller kontakte os på 915-850-0900 .
Kurateret af Dr. Alex Jimenez
Henvist fra: Sciencedirect.com

Yderligere emnediskussion: Akut rygsmerter
Rygsmerte er en af de mest almindelige årsager til handicap og savnede dage på arbejdspladsen over hele verden. Rygsmerter tilskrives den næst mest almindelige årsag til lægebesøg, udelukkende kun ved øvre respiratoriske infektioner. Ca. 80 procent af befolkningen vil opleve rygsmerter mindst én gang i hele deres liv. Ryggraden er en kompleks struktur bestående af knogler, led, ledbånd og muskler, blandt andet blødt væv. På grund af dette skader og / eller forværrede forhold, som f.eks herniated diske, kan i sidste ende føre til symptomer på rygsmerter. Sportsskader eller personskader er ofte den hyppigste årsag til rygsmerter, men nogle gange kan de enkleste bevægelser have smertefulde resultater. Heldigvis kan alternative behandlingsmuligheder, såsom kiropraktisk pleje, hjælpe lindring af rygsmerter ved brug af rygtilpasninger og manuelle manipulationer, der i sidste ende forbedrer smertelindring.

EKSTRA EKSTRA | VIGTIGT EMNE: Anbefalet El Paso, TX Kiropraktor
***
Post Ansvarsfraskrivelse
Oplysningerne heri om "Den fremvoksende rolle Nrf2 i mitokondrielle funktion" er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletale, akupunktur, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) i Florida
Florida Licens RN Licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
I øjeblikket matrikuleret: ICHS: MSN* FNP (Program for familiesygeplejerske)
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort


 Igen byder vi velkommen¸
Igen byder vi velkommen¸
